
Termokimia Menghitung entalpi reaksi dengan menggunakan hukum Hess (Part 1) YouTube
Berikut adalah contoh soal hukum Hess dalam kimia: Diberikan reaksi: 2H2 (g) + O2 (g) → 2H2O (g) ΔH1 = -484 kJ/mol H2 (g) + 1/2O2 (g) → H2O (l) ΔH2 = -286 kJ/mol Hitung ΔH untuk reaksi: H2 (g) + 1/2O2 (g) → H2O (g) Jawaban: Untuk menghitung ΔH reaksi ini, kita harus menggunakan hukum Hess. Kita dapat memecah reaksi yang diinginkan.

KELAS 11 IPA LATIHAN SOAL HUKUM HESS
Video ini berisi penjelasan lengkap, contoh-contoh soal dan pembahasan tentang cara menghitung perubahan entalpi dengan menggunakan hukum Hess.Semoga video i.

Contoh Hukum Hess
Menelaah Rumus Hukum OHM dan Contoh Soalnya. Terdapat 3 cara untuk mencari ∆Hreaksi menggunakan Hukum Hess sebagai berikut. 1. Cara Diagram. Sesuai dengan Hukum Hess, yang diperhatikan adalah awal dan akhir diagram. Dari diagram diketahui bahwa reaksi 1/2N₂ (g)+O₂ (g) sebesar -90,25 kj dan NO₂ (g) sebesar -57,05 kj.

Contoh Soal Hukum Hess
Contoh Soal Hukum Hess dan Pembahasannya. Untuk mengasah kemampuanmu, yuk simak beberapa contoh soal hukum Hess dan pembahasannya berikut ini. Contoh 1. Diketahui ΔH f CO 2 = -396 kJ mol-1 dan ΔH c CO = -284 kJ mol-1. Tentukan ΔH f CO dengan diagram bertingkat hukum Hess. Pembahasan

Pembahasan Soal Termokimia Hukum Hess (3) (Cara Menentukan ΔHf CH4 & Diagram Tingkat Energinya
Hukum Hess adalah hukum yang digunakan untuk menentukan besarnya perubahan entalpi suatu reaksi. Dalam hukum Hess, nilai perubahan entalpi dinyatakan sebagai fungsi keadaan (∆ H).Menurut hukum ini, karena perubahan entalpi merupakan fungsi keadaan maka perubahan reaksi kimia akan bernilai sama meskipun langkah-langkah yang diperlukan untuk menghasilkan hasil reaksi berbeda.

Contoh Soal Hukum Hess Bentuk Diagram Energi YouTube
Contoh Hukum Hess. Pada diagram di atas, jelas bahwa jika C ( s) + 2H 2 ( g) + O 2 ( g) direaksikan menjadi CO 2 ( g) + 2H 2 ( g) mempunyai perubahan entalpi sebesar -393,5 kJ. Walaupun terdapat reaksi dua langkah, tetap saja perubahan entalpi akan selalu konstan (-483,6 kJ + 90,1 kJ = -393,5 kJ). Hukum Hess menyatakan bahwa perubahan entalpi.

Gunakan hukum Hess untuk menghitung perubahan entalpi rea...
Hukum-hukum yang terkait dengan termokimia adalah hukum Hess yang dikemukaan oleh German Henry Hess pada tahun 1849.. Baca juga: Perubahan Entalpi pada Reaksi Kimia Hukum Hess. Dilansir dari bbc.co.uk, hukum hess menjelaskan bahwa setiap reaksi kimia memiliki perubahan total entalpi yang tetap dan tidak tergantung pada tahapan atau jalur reaksinya.. Maka perubahan entalpi hanya bergantung pada.

Pembahasan Soal Termokimia Hukum Hess dengan Susun Reaksi (1) YouTube
Perhatikan contoh berikut. Dalam penerapan hukum Hess, kadangkala persamaan termokimia yang tersedia perlu dimanipulasi terlebih dahulu. Berikut aturan dalam memanipulasi persamaan termokimia: Ketika persamaan reaksi dibalik (reaktan menjadi produk, produk menjadi reaktan), tanda nilai ΔH juga harus dibalik (dari positif menjadi negatif, dan.

Hukum Hess KIMIA KELAS 11 YouTube
Contoh soal hukum Hess nomor 6. Diagram tahap reaksi pembentukan gas SO 3 adalah sebagai berikut. Contoh soal hukum Hess nomor 6. Berdasarkan diagram tersebut, harga ΔH 2 adalah. A. 790,4 kj B. 593,8 kj C. 250,6 kj D. -250,6 kj E. -593,8 kj. Pembahasan. Menurut hukum Hess, pada gambar diatas berlaku: ΔH 3 = ΔH 1 + ΔH 2; ΔH 2 = ΔH 3.

Contoh Soal Hukum Hess YouTube
Contoh Soal Hukum Hess dan Penyelesaian. Hukum Hess berbunyi "perubahan entalpi suatu reaksi hanya tergantung pada keadaan awal (zat-zat pereaksi) dan keadaan akhir (zat-zat hasil reaksi) dari suatu reaksi kimia dan tidak bergantung pada jalannya reaksi. Secara matematis, Hukum Hess dirumuskan sebagai berikut, ∆H reaksi = ∆H 1 + ∆H 2.

Contoh Soal Hukum Hess Bentuk Bagan YouTube
Contoh Soal dan Pembahasan Hukum Hess. Tentukah ΔH dari diagram di bawah ini: Perhatikan gambar di atas bahwa jika C (s) + 2H 2 (g) + O 2 (g) direaksikan menjadi CO 2 (g) + 2H 2 (g) mempunyai perubahan entalpi sebesar -393,5 kJ. Meskipun terdapat reaksi dua langkah, tetap saja perubahan entalpi akan selalu konstan :
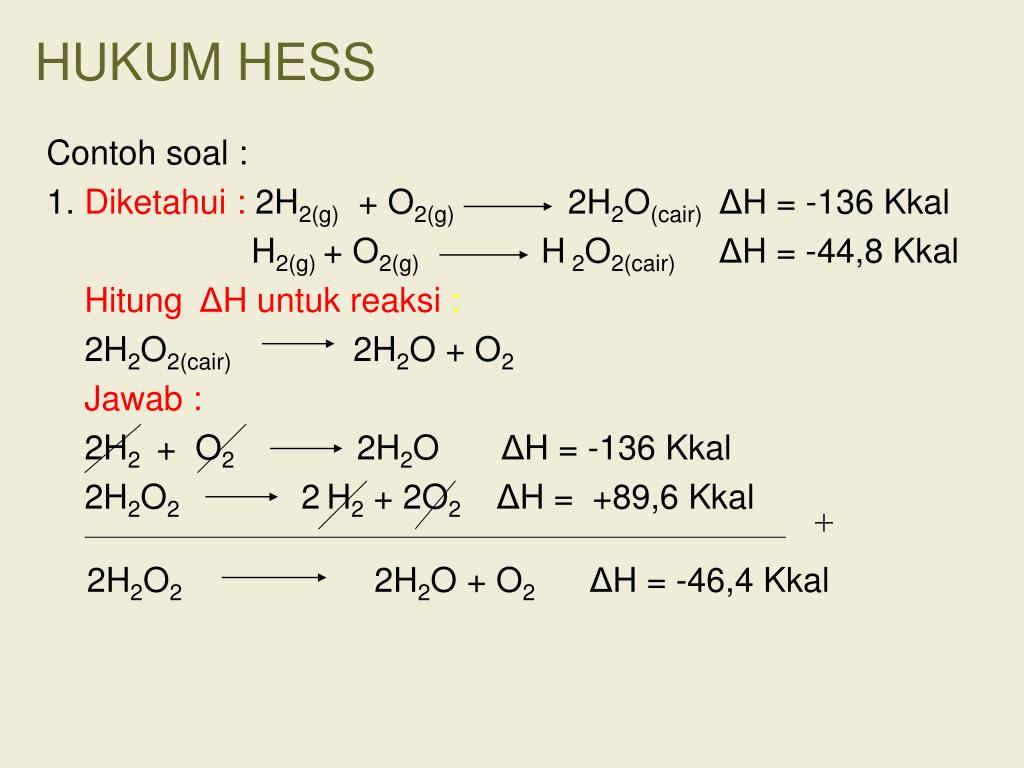
Soal Dan Pembahasan Hukum Hess
Kegunaan Hukum Hess. Adapun fungsi dari hukum Hes ialah guna memprediksi adanya suatu perubahan entalpi dari hukum kekekalan energi yang mana hal ini dinyatakan sebagai fungsi kondisi ΔH. Kemudian Hukum Hes juga bisa dimanfaatkan guna menghitung jumlah entalpi secara menyeluruh atas proses reaksi kimia meskipun memakai rute reaksi yang berbeda.

Soal Hukum Hess LEMBAR EDU
Latihan Soal Hukum Hess (Sukar) Penguraian 3,6 gram besi (II) oksida dibutuhkan energi 13,6 kJ. Penguraian 4 gram besi (III) oksida dibutuhkan energi 20,605 kJ. Pembentukan 9,28 gram Fe3O4 dilepaskan energi 44,736 kJ. Berdasarkan data di atas berapakah ΔH reaksi dari Fe3O4(s) → FeO(s)+ Fe2O3(s) adalah. .

Contoh Soal Hukum Hess Dan Penyelesaiannya Gudang Materi Online
Bunyi Hukum Hess Berikut ini adalah bunyi hukum hess: Jumlah panas yang dibutuhkan atau dilepaskan pada suatu reaksi kimia tidak tergantung pada jalannya reaksi tetapi ditentukan oleh keadaan awal dan akhir. Rumus Hukum Hess Perhatikan gambar di atas, mereaksikan A dengan D dapat menempuh jalur B dan C. dengan merubah entalpi yang sama: ΔH1 + […]

Contoh Soal Hukum Hess LEMBAR EDU
Video penjelasan Hukum Hess dan cara menentukan entalpi reaksi menggunakan Hukum Hess beserta contoh soal.Kimia Kelas 11#hukumhess

Contoh Soal Hukum Hess dengan menggunakan data delta Hf (di akhir ada cara cepatnya) YouTube
ΔH 1 = ΔH 2 + ΔH 3. x = y + z. Menurut Hukum Hess : ΔH 1 = ΔH 2 + ΔH 3 atau x = y + z. Perubahan yang terjadi dari N 2 g) dan O 2 g) menjadi NO (g) disertai dengan adanya perubahan entalpi (ΔH 1) sebesar +33,85 kJ/mol, walau pun reaksi telah ditetapkan dalam satu tahap atau pun dua tahap, ΔH 1 = ΔH 2 + ΔH 3.